
آلکاپتونوریا
این بیماری یک اختلال تک ژنی با الگوی وراثت اتوزومال مغلوب[1] می باشد که میزان بروز[2] آن 1 در 250000 تا 1 در 1000000 تولد در جهان تخمین زده می شود. آلکاپتونوریا به وسیله گارود به عنوان یک اختلال متابولیسم مادرزادی در اوایل قرن بیستم شرح داده شد. در نهایت وی با مطالعاتی که بر روی بیماران آلکاپتونوریا و خانواده هایشان کرد این ایده که اختلالات مادرزادی متابولیسمی نتیجه نقص یک آنزیم است، را ارائه کرد. این نظر بعدها پایه گذار فرضیه یک ژن یک آنزیم شد. بروز این بیماری در هر دو جنس برابر است ولی فنوتیپ بیماری در مردان شدیدتر می باشد.

شکل ۱: مسیر متابولیکی اسید آمینه در افراد سالم و مبتلا به آلکاپتونوریا
ژنتیک بیماری
جایگاه کروموزومی ژن دخیل یعنی ژن هموژنتیسات ۱و۲-دی اکسیژناز (HGD) لوکوس 3q21-23 می باشد. 90% بیماران دارای جهش بد معنی هستند ولی جهش های بی معنی و اینترونیک که موجب تغییر چارچوب خواندن می گردند، نیز مشاهده شده است. ژن HGO انسانی در قارچ آسپرژیلوس نیدولانس کلون شد. این ژن پروتئین 445 اسید آمینه ای که دارای همولوژی بالایی با ژن Aspergillus hmgA است، را کد می کند. بیان بالا HGO در پروستات، روده کوچک، کلون و کبد با نورترن بلات به اثبات رسیده است. این ژن دارای 14 اگزون می باشد و حدود 60 kb از ژنوم را در بر می گیرد. پلی مورفیسم های مختلفی در این ژن وجود دارد. این ژن یک پروتئین 49973 دالتونی با 445 اسید آمینه ای که یک دایمر متشکل از دو تریمر که ایجاد یک هگزامر کاربردی می کند، را کد می نماید. اغلب جهش های بیماری زا در اگزونهای 3، 6، 8 و 13 قرار دارند.

شکل ۲: محل قرارگیری لوکوس ژن HGD در کروموزوم ۳
در بحث همبستگی ژنوتیپ-فنوتیپ[3]، می دانیم که کبد انسان روزانه ۱/۵ کیلوگرم اسید هموژنستیک را بوسیله آنزیم اسید هموژنستیک اکسیداز تجزیه می نماید. برای بروز علایم بیماری باید آنزیم فعالیت خود را تا 99% از دست دهد. تنوع در میزان فعالیت آنزیم در رابطه با میزان ارتباط ژنوتیپ با فنوتیپ به روشنی مشخص نیست. مطالعه اثر جهش های متفاوت بر روی میزان فعالیت آنزیم مذکور انجام گرفت که نشان داد، جهش هایی که کاهش متعادل فعالیت آنزیم را در پی دارند، همیشه با بروز همراه نیست.
علایم بالینی
بیماران آلکاپتونوریا معمولا در ظاهر قابل تشخیص نمی باشند. ادرار آن ها در صورت که در مجاورت هوا باقی بماند، تیره می گردد. ادرار این بیماران حاوی مقدار زیادی مواد قلیایی[4] است که علت تیرگی آن در زمان مجاورت در هوا می باشد. در بیماران مبتلا به آلکاپتونوریا هیچ نشانه ای در سنین کودکی یا بالغین جوان، مگر در موارد نادر، دیده نمی شود. در سنین بالاتر پیگمان های روی صلبیه یا غضروف گوش مشاهده می گردد که به آن ها اکرونوز گفته می شود. پراکندگی گسترده ای این پیگمان ها در نواحی غضروف گوش، صلبیه و بافت های پیوندی مشاهده می شود. پیگمان ممکن است در جراحی با در معرض هوا قرار گرفتن بافت ها سریعا ظاهر شوند. این پیگمان ها می توانند در سرتاسر پوست از جمله چانه، پیشانی، زیر بغل و ناحیه تناسلی و همچنین در بیماران بزرگسال آرتریت اکرونوزیک[5] نیز مشاهده شوند. در برخی از این بیماران روماتوئید آرتریت به علت وجود یک دوره حاد التهابی مشاهده می شود. کاهش حرکت مفاصل و آنکیلوزها[6] معمولا در پی واکنش های التهابی بوجود می آیند. ممکن است فضای دیسک های بین مهره ای دچار رسوب کلسیم گردد، حتی گاهی فیوژ شدن مهره ها که به آن اصطلاحا تظاهر نی مانند می گویند، نیز دیده می شود. در مقایسه با بیماری روماتوئید استئوفیت یا کلسیفیکیشن کمتری وجود دارد. میانگین این ضایعات حدوداً 8 سانتی متر هستند. در مقایسه با استئوآرتریتیک بیشترین صدمه ها در دو ناحیه کفل و شانه می گذارند که معمولا با اکرونوز همراه است، البته در اتصال ساکروایلیاک دیده نمی شود. در حالیکه در استئوآرتریتیک مفاصل دچار صدمه شده اند و کلسیفیکیشن وتر ها را در بر گرفته است. در بیماران مبتلا به آلکاپتونوریا آتریتیس می توان موجب بستری شدن حتی احتیاج به صندلی چرخ دار را موجب گردد. ناراحتی های قلبی در بیماران مبتلا به آلکاپتونوریا بسیار شایع می باشند. التهاب دریچه های میترال و آئورتی ممکن در کالبدشکافی دیده شود. آماس آئورتیک یا کلسیفیکیشن دریچه های میترال و آئورت معمولا وجود دارد. انفارکتوس میوکارد که معمولا موجب مرگ می گردد در پی کلسیفیکیشن رگ های قلبی ایجاد می شود. همچنین در سنین بالاتر بیماران دچار سنگ کلیه هم می گردند. بروز علایم همچون اکرونوز و مشکلات اسکلتی عضلانی از سن 30 سالگی رخ می دهند.

شکل ۳: اکرونوز در صلبیه چشم و لاله گوش
بیماریزایی
هموژنتیسیک اسید یک میان واکنش طبیعی در کاتابولیسم اسید آمینه های آروماتیک فنیل آلانین و تیروزین می باشد. تجمع این ماده بر اثر نقص در فعالیت هموژنتیسیک اسید اکسیداز می باشد. این آنزیم در کبد و کلیه پستانداران وجود دارد. این آنزیم هموژنتیسیک اسید به مالیل استواستیک تبدیل می نماید که نهایتا به فوماریک و استواستیک تبدیل می گردد. در این بیماران هموژنتیسیک اسید به بنزوکئوینن استیک اسید تبدیل می گردد که منومر های تشکیل دهنده پیگمان های پلی مر اکرونوتیک می باشند.

شکل ۴: در بیماران مبتلا به آلکاپتونوریا هموژنتیسیک اسید به بنزوکوینن استیک اسید که منومر پلی مر های سیاه هستند، تبدیل می گردد.
روش تشخیص
ادرار بطور طبیعی حاوی گلوکز نمی باشد، بنابراین تست ادرار فقط با استفاده از گلوکز اکسیداز، قادر به شناسایی آلکاپتونوریا می باشد. هموژنتیسیک اسید، نقره ی درون شیره محلول کلودین عکاسی را احیا می کند. هموژنتیسیک اسید با استفاده کروماتوگرافی کاغذی نیز قابل شناسایی است که اغلب در ادرار و ارگانیک اسید پیدا می شود. برای اندازه گیری مقدار آن از روش کروماتوگرافی HPLC استفاده می شود. یک بالغ مبتلا به آکندروپلازیا روزانه 8-4 گرم اسید هموژنتیسیک دفع می گردد. ترکیبات دفع شده در بیماران در پلاسما خون شان بسیار کم یافت می گردد. البته مقدار ایزوتوپ های پایدار پلاسما این بیماران که با استفاده از کروماتوگرافی گازی استاندارد اندازه گیری شده است، بیشتر از پلاسمای فرد طبیعی می باشد. در عکس های رونتگنوگرافی[7] استئوآتریتیس متعددی در این بیماران دیده می شود. با آنالیز جهش DNA روی سلول های جنین از نمونه های آمنیوسنتز و CVS نوع جهش مسبب بیماری در ژن مذکور مشخص می گردد و می توان در سایر اعضا خانواده وجود این جهش را چک کرد.

شکل ۵: نمونه ادرار (Aقبل و (Bبعد ا ز اضافه شدن هیدروکسید سدیم

شکل ۶: عکس رادیولوژی مهره های کمر از پهلو یک بیمار مبتلا به آلکاپتنوریا که کاهش فضای دیسک و اسکلیوزیس را نمایش میدهد.
مدیریت بالینی
استفاده از ترکیبات کاهنده مانند اسکوربیک اسید که مانع اکسید شدن هموژنتیسیک اسید به بنزوکوینن استیک اسید می شود اما موجب کاهش میزان هموژنتیسیک اسید در ادرار بیماران نمی گردد ولیکن تمایل تیره شدن ادرار بیماران را در مجاورت هوا کاهش می دهد. هموژنتیسیک اسید مهارکننده رشد سلـول هـای کنـدروسیـت مفاصـل انسـان می باشد که اسید اسکوربیک می تواند با تشکیل C-هموژنتیسیک اسید مانع اتصال هموژنتیسیک اسید به بافت های همبند شده و از اثرات منفی آن بر روی مفاصل جلوگیری کند.
درمان
درمان با 2- (2- نیترو 4- تری فلورومتیل بنزویل) 1،3- سیکلوهگزاندیون یا NTBC(نیتیسینون) موفقیت آمیز می باشد. این ماده مهارکننده 4- هیدروکسی فنیل پیروات دی اکسیژناز است که تولید کننده هموژنتیسیک اسید می باشد NTBC در درمان تیروزینمیا تیپ I نیز موفقیت آمیز هست. بـرای درمان آتریتیـس اورتوپدی توصیه می گردد. حدود 50% بیماران به جراحی کفل، زانو و شانه احتیاج پیدا می کنند.
[1] Autosomal recessive
[2] Incidence
[3] Genotype-phenotype correlation
[4] Alkali
[5] Ochronotic arthritis
[6] Ankyloses
[7] Roentgenographic
هتروژنی آللی یا موتاسیونی [1] به حالتی گفته می شود که جهش های متفاوت در یک ژن موجب ایجاد یک بیماری ژنتیکی شوند که در اکثر بیماری های ژنتیکی با توارث اتوزومال مغلوب می توان آن را مشاهده کرد. بعنوان مثال در بیماری های
در اینگونه بیماری های ژنتیکی شما می توانید شاهد هتروزیگوت مرکب [2] یعنی ایجاد یک بیماری با توارث اتوزومال مغلوب با جهش های متفاوت در یک ژن باشید.
[1] Allellic or mutational heterogeneity
[2] Compound Hetrozygotes
هتروژنی لوکوسی [1] یا هتروژنی ژنی به این معناست که جهش در ژن های متفاوت با لوکوس های متفاوت موجب یک اختلال ژنتیکی یکسان شوند. این پدیده در بیماری های ژنتیکی بسیاری قابل مشاهده است به عنوان مثال:
در بیماری های ژنتیکی که دارای هتروژنی لوکوسی هستند پدیده دیگری به نام هتروزیگوت های دوگانه [2] دیده می شود که به این معناست که فرد دارای جهش های هتروزیگوت در لوکوس های متفاوت می باشد. این حالت در زمانی رخ می دهد که والدین وی دارای یک اختلال ژنتیکی با توارث اتوزومال مغلوب ولی به علت جهش در ژن های متفاوت باشد.
[1] Locus Heterogeneity
[2] Double Heterozygotes
آلبینیسم (زالی)
آلبینیسم جزء گروه بیماری های ارثی دارای نقص در سنتز ملانین می باشد که منجر به کاهش رنگدانه ای مادرزادی می گردد. در صورتیکه پوست، مو و چشم ها را در بر گیرد به آن آلبینیسم چشمی - پوستی[1] و در صورتیکه فقط محدود به چشم ها شود به آن آلبینیسم چشمی[2] گویند. در آمریکا تخمین زده شده است که از هر 17000 نفر یک نفر مبتلا به آلبینیسم می باشد.
بیماری آلبینیسم دارای هتروژنتی ژنی می باشد که بر این اساس به دو دسته تقسیم می گردد. دسته اول آلبینیسم چشمی - پوستی (OCA) فنوتیپ معمول برای یک اختلال ژنتیکی مغلوب نقص در سنتز ملانین است. جهش ها در 12 ژن موجب این فنوتیپ می شود. جهش در این ژن ها موجب کاهش سنتز ملانین در ملانوسیت ها می گردد. آلبینیسم چشمی - پوستی که فقط پوست و چشم درگیر می کند به آلبینیسم چشمی - پوستی نوع یک (OCA1) به سه گروه OCA1A, OCA1B, OCA1ts، آلبینیسم چشمی - پوستی نوع دو OCA2 آلبینیسم چشمی - پوستی نوع سه OCA3، آلبینیسم چشمی - پوستی نوع چهار OCA4، آلبینیسم چشمی - پوستی نوع پنج OCA5، آلبینیسم چشمی - پوستی نوع شش OCA6 و آلبینیسم چشمی - پوستی نوع هفت OCA7 طبقه بندی می شود. تیپ های نامعمول آلبینیسم چشمی - پوستی با بروز پیچیده ای مانند هرمانسکی- پودلاک[3] سندرم هاوچدیاک- هیگاشی سندرم[4] را می توان نام برد.
دسته دوم آلبینیسم چشمی به دو نوع، آلبینیسم چشمی نوع اول (OA1) که دارای توارث وابسته به X مغلوب است و آلبینیسم چشمی با توارث اتوزومال مغلوب (AROA) تقسیم می شوند.
ملانین یک رنگدانه محافظ در برابر نور در پوست می باشد. UV نور خورشید را جذب می نماید و از تخریب پوست جلوگیری می کند. پوست طبیعی در برابر نور خورشید رنگدانه ملانین پوست را افزایش می دهد. بیماران مبتلا به آلبینیسم برای سوختگی آفتاب دارای ریسک بالاتری هستند.

شکل1: مسیر متابولیکی سنتز ملانین از تیروزین را نشان می دهد.
ژنتیک بیماری:
عامل بیماری OCA1 جهش های ژن تیروزیناز (TYR) واقع بر 11q14.21 می باشد. تیپ های مختلفی از این جهش ها (بد معنی، بی معنی و تغییر چارچوب) وجود دارند که موجب OCA1A و OCA1B می شوند. در تیپ OCA1A که آلبینیسم تیروزیناز منفی (آنزیم کاملا غیر فعال) است در اثر جهش های نال[5] ژن تیروزیناز می باشد. بیش از 100 جهش در طول این ژن گزارش شده است. هتروزیگوت های مرکب حاصل از جهش های مختلف والدین نیز موجب این بیماری می شوند.
در تیپ OCA1B تیروزیناز با فعالیت کم که ناشی از جهش های لیکی[6] در ژن تیروزیناز می باشد دیده می شود. در این تیپ زرد آلبینیسم 5-10% فعالیت آنزیم تیروزیناز وجود دارد که ناشی از جایگزینی باز در این ژن است که موجب کاهش فعالیت آنزیم شده است.
OCA1st در این تیپ از بیماری آنزیم تیروزیناز نسبت به دما ناپایدار می باشد و موجب کاهش فعالیت طبیعی آنزیم می گردد. اولین بیماری که با این تیپ گزارش شد دارای یک جهش بد معنی در ژن آنزیم تیروزیناز بود.
OCA2 آلبینیسم با فعالیت طبیعی تیروزیناز، جهش های ژن رقت چشم صورتی[7] یا ژن P که در جایگاه کروموزومی 15q11-13 قرار دارد را مسئول این فنوتیپ می دانند. همولوگ این ژن در موش ژن رقت چشم صورتی یا ژن P نام دارد. این منطقه تغییر یافته در سندرم های پرادرویلی و آنجلمن حذف شده است که گویا رابطه نزدیک بین OCA2 با سندرم های پرادرویلی و آنجلمن می باشد.
OCA3 یا آلبینیسم قهوه ای حاصل جهش در ژن پروتئین یک وابسته به تیروزیناز[8] (TRP1) واقع در 9p23 می باشد. این ژن همولوگ ژن قهوه ای در موش است. جهش در این ژن موجب سینرژیستیک با پلی مورفیسم یا جهش های با فعالیت کاهش یافته در OCA1 یا OCA2 می شوند.
OCA4 حاصل جهش در ژن MATP واقع در 5p13.2 می باشد که دارای 7 اگزون است و حدودا 40 kb از DNA ژنومیک را در بر می گیرد. پروتئین MATP 530 اسید آمینه ای شامل 12 دومین ترانس ممبرن می باشد که توالی و ساختار بسیار شبیه ترانس ممبرن های ساکاروز گیاهی است که در سلول های ملانوزومال مشاهده می شود.
OCA5 نتیجه اختلال واقع در 4q24 می باشد که هنوز ژن آن ناشناخته است.
OCA6 نتیجه جهش در ژن SL24A5 واقع در15q21.1 می باشد.
OCA7 نتیجه جهش در ژن C10ORF11 واقع در 10q22 می باشد.
بیماریزایی:
ملانین یک رنگدانه محافظ کننده در برابر نور خورشید در پوست می باشد که اشعه UV موجود در نور خورشید را جذب می نماید و از تخریب پوست جلوگیری می کند. در پوست طبیعی در برابر نور خورشید میزان ملانین افزایش می یابد تا از تخریب پوست جلوگیری نماید اما در بیماران مبتلا به آلبینیسم این توانایی وجود ندارد و میزان آفتاب سوختگی را افزایش می دهد. نتیجه فقدان ملانین در طول تکوین چشم هیپوپلازی فووآ [9] و تغییرات ارتباطات عصبی مابین شبکیه و مغز می باشد. در مسیر متابولیکی ملانین یک سری واکنش وجود دارد که تیروزین را به دو تیپ ملانین ایملانین سیاه-قهوه ای[10] و فئوملانین قرمز-بلوند[11] تبدیل می نمایید. تیروزیناز یک آنزیم اصلی در مراحل تبدیل کننده تیروزین به ملانین می باشد و همچنین مسئول تبدیل تیروزین به DOPA و سپس به دوپاکوینون که در پی آن به ایملانین یا فئوملانین می باشد. در بیماران مبتلا به آلبینیسم چشمی- پوستی در اثر جهش در این ژن پروتئین تیروزیناز در شبکه آندوپلاسمی باقی می ماند و تخریب می گردد و در نتیجه بیوسنتز ملانین دچار اختلال می شود.
دو آنزیم دیگر که در ایجاد ایملانین درگیر می باشند عبارتند از پروتئین وابسته یک به تیروزیناز[12](TRP1,DHICA oxidase) و پروتئین وابسته دو به تیروزیناز[13](TRP2, dopachrome tautomerase). جهش در TRP1 موجب بیماری OCA3 و در TRP2 ایجاد آلبینیسم نمی نماید. پروتئین P یک پروتئین غشایی ملانوزومال[14] که اعتقاد بر این است که انتقال دهنده تیروزین برای سنتز ملانین می باشند. جهش در ژن P موجب ایجاد بیماری OCA2 می گردد.
تکوین سیستم بینایی وابستگی زیادی به وجود رنگدانه ملانین دارد. مسیریابی اشتباه مسیر های رتینوگنیکولات که نتیجه غیرطبیعی بودن تقاطع فیبر های عصبی بینایی است. پراکندگی نور در چشم باعث احساس ترس از نور و کاهش بینایی می شود. نور تخریب شبکیه را تشدید می کند و موجب کاهش بینایی می گردد. هیپوپلازی فووآ فاکتور اصلی کاهش دید در این بیماران می باشد.

شکل 2: مقایسه ساختار تقاطع فیبرهای تمپورال[15] در چشم طبیعی و بیمار مبتلا به آلبینیسم
علائم بالینی:
پوست، مو و چشم بی رنگ در اثر عدم سنتز ملانین علامت شاخص بیماری است که ممکن در آلبینیسم چشمی مشهود نباشند. کاهش توانایی بینایی به علت هیپوپلازی فووآ، عنبیه مات در اثر کاهش رنگدانه های عنبیه، رگ های کوروئیدی آشکار به علت کاهش پیگمان های شبکیه، ترس از نور به علت غیر طبیعی بودن رنگدانه های عنبیه، مسیرهای غیر طبیعی بینایی در اثر کیاسما غیر طبیعی فیبرهای عصبی بینایی، انحراف چشم متناوبی[16]، دوربینی[17]، نزدیک بینی[18] و استیگماتیسم در این بیماران معمولا مشاهده می شود.
شیوع آلبینیسم چشمی - پوستی تیپ یک (OCA1) حدوداً 1 در 40000 نفر می باشد. در بیماری OCA1A فنوتیپ همانند OCA تیروزیناز منفی کلاسیک می باشد. فرم غالب این بیماری است. مو و پوست سفید بدون اسمر و عنبیه آبی و مات (که با افزایش سن تیره نمی شود)، هیپوپلازی فووآ، دارای خطر آفتاب سوختگی و سرطان پوست، کاهش توانایی بینایی کمتر از 400/20، ترس از نور و نیستاگموس در این تیپ نیز مشاهده می شوند.

شکل ۳: نوزاد مبتلا به آلبینیسم چشمی و پوستی تیپ OCA1A
به آلبینیسم چشمی - پوستی یک B(OCA1B) موتانت زرد تیپ OCA یا آمیش آلبینیسم[19] و یا اکسانتوس آلبینیسم[20] نیز اطلاق می گردد. در این تیپ درجات رنگدانه های پوست از کمترین مقدار تا نزدیک به پوست طبیعی متغییر می باشد. رنگدانه های پوست، مو و چشم با افزایش سن بیشتر می شوند. همین طور لک های پوستی در اثر نور خورشید در این بیماران مشاهده می شود. رنگدانه مو زرد در سال های اولیه زندگی به فئوملانین قرمز- زرد[21] در مو، چشم و پوست تبدیل می گردد. کاهش بینایی با افزایش سن اصلاح می شود.

شکل ۴: دو فرزند مبتلا به آلبینیسم OCA1B یک خانواده را نشان می دهد که در فرزند اول رنگدانه های پوست، مو و چشم با افزایش سن بیشتر شده است و رنگ موی او به قرمز تغییر رنگ پیدا کرده است. در فرزند نوزاد خانواده علایم بیماری شدیدتر قابل رویت می باشد.
آلبینیسم حساس به دما (OCA1st) یک زیر تیپ OCA1B می باشد. موتاسیون در ژن تیروزیناز که باعث ایجاد یک آنزیم تیروزیناز حساس به دما می گردد. فعالیت آنزیم تیروزیناز حساس به گرما حدوداً 25% فعالیت آنزیم تیروزیناز طبیعی را در دمای 37 سانتیگراد دارا می باشد. مو در دست ها و پا ها (نواحی سرد تر بدن) تیره و در زیر بغل و فرق سر سفید می باشد. رنگدانه در دوران جنینی در این بیماران وجود ندارد زیرا دمای بدن جنین بالا است.
شیوع تقریبی آلبینیسم چشمی - پوستی تیپ دو (OCA2) یا آلبینیسم چشمی - پوستی تیروزیناز مثبت 1 در 15000 نفر می باشد. این تیپ از بیماری دارای فنوتیپ های متغییری است. درجات متفاوتی از فقدان رنگدانه حتی وجود رنگدانه به مقدار پوست طبیعی، فقدان رنگدانه سیاه (ایوملانین[22]) در پوست، مو و چشم در هنگام تولد، تکوین آهسته رنگدانه با افزایش سن، افزایش رنگدانه که موجب اصلاح بینایی می گردد در این بیماران مشاهده می شود.

شکل ۵: شخص مبتلا به آلبینیسم OCA2 آفریقا جنوبی که دارای جهش در ژن P می باشد. وی دارای موهای قهوهای روشن و پوست روشن همراه با نیستاگموس است.
آلبینیسم چشمی - پوستی تیپ سه (OCA3) که قبلا به آن آلبینیسم چشمی - پوستی قرمز/خرمایی گفته می شد. شیوع آن مشخص نشده است. فنوتیپ آن در بیماران آفریقایی مو و پوست قهوه ای روشن، عنبیه آبی- قهوه ای می باشد. فنوتیپ چشم در این بیماران با علائم رایج مانند عنبیه مات، نیستاگموس، استرابیسم یا هیپوپلازی فووآ همراهی ندارد. فنوتیپ این نوع بیماری در سفید پوستان اروپایی و آسیایی ها ناشناخته است.

شکل ۶: نوزاد مبتلا به آلبینیسم چشمی و پوستی تیپ OCA3 می باشد.وی دارای موهای قهوهای و کاهش پیگمانهای پوست است.
آلبینیسم چشمی – پوستی تیپ چهار (OCA4) دارای شیوع 1 در 85000 در ژاپن و در سفید پوستان اروپایی است و بسیار نادر می باشد. فنوتیپ های بیماران OCA4 پوست رنگ پریده، مو سفید یا زرد یا قهوهای و چشم آبی- خاکستری مات همراه با اختلالات چشمی همچون کاهش بینایی، هیپوپلازی ماهیچه، دیسپلازی چشمی، رگهای کوروئیدی غیرطبیعی و نیستاگموس را می توان نام برد. جهش های این ژن اولین بار در بیمار OCA ترکی پیدا شد و بعد در بیماران آلمانی، ژاپنی و کره ای نیز مشاهده شد.

شکل ۷: شخص مبتلا به آلبینیسم OCA4 که دارای جهش در ژن MATP می باشد. همانطور گه در شکل مشاهده میشود کاهش پیگمان در پوست، مو و چشم در زمان کودکی و بزرگسالی شدت یکسانی داشته است.
در آلبینیسم چشمی – پوستی تیپ پنج (OCA5) فنوتیپ بیماران موهای طلایی، پوست سفید، همراه با اختلالات بینایی همچون کاهش بینایی، هیپوپلازی فووآ، فتوفوبی و نیستاگموس گزارش شده است.

شکل ۸: فرد مبتلا به آلبینیسم OCA5 را نشان می دهد.
در آلبینیسم چشمی – پوستی تیپ شش (OCA6) فنوتیپ بیماران موهای طلایی که با افزایش سن تیره می گردد، پوست سفید، عنبیه شفاف و قهوه ای همراه با کاهش بینایی، فتوفوبی، نیستاگموس ملایم، هیپوپلازی فووآ و هیپوپیگمنتاسیون فاندوس می باشد.

شکل ۹: شخص مبتلا به آلبینیسم OCA6 که دارای موها و عنبیه قهوه ای است.
در آلبینیسم چشمی – پوستی تیپ هفت (OCA7) فنوتیپ بیماران موهای بلوند تا قهوهای می گردد، پوست رنگ پریده، عنبیه مات، نیستاگموس ، تجمع رنگدانه ها بطور پراکنده در فوکوس و هیپوپیگمنتاسیون فاندوس می باشد.

شکل ۱۰: دختر مبتلا به آلبینیسم OCA7 می باشد.
راه های تشخیص:
آزمایش اپتالمواوژیک[26] برای تشخیص کاهش رنگدانه های شبکیه همراه با رگ های خون کورویدال (OCA1) و هیپوپلازی فووآ مورد استفاده قرار می گیرد. سنجش میزان بینایی و استفاده از آزمایش انکوباسیون پیاز مو [27] برای سنجش فعالیت آنزیم تیروزیناز نیز روش مناسبی برای افتراق تیپ های مختلف این بیماری از هم می باشد.

شکل ۱۱: قسمت a فاندوس فرد مبتلا به آلبینیسم و قسمت b فاندوس چشم طبیعی را نشان می دهد.
نمونه گیری از پوست و پیاز مو و مشاهده آن با میکروسکوپ الکترونی که راه معمولی برای تشخیص بیماری نمی باشد ولی روش دقیقی است. آزمایش اولتراستراکشن پوست که حضور ماکروملانوزوم ها در پوست که اختصاص به OCA1 می باشد، تشخیص این نوع بیماری را میسر می سازد[4]. آنالیز مولکولی برای یافتن جهش در ژن های مذکور روش دقیقی برای تشخیص این بیماری و تیپ های آن از هم می باشد که به روش های تشخیصی دیگر برتری دارد. آنالیز توالی یابی ژن تیروزیناز تشخیص صحیح و دقیق تیپ های مختلف آلبینیسم را از هم میسر می سازد که این تست بیشتر برای شناسایی افراد ناقل ژن معیوب مورد استفاده قرار می گیرد. تست مولکولی برای تمامی ژن های مذکور می تواند راه تشخیصی دقیقی باشد و بدنبال آن تشخیص قبل از تولد از طریق آنالیز مستقیم جهش DNA از پرزهای کوریونی میسر می باشد[5].
مشاوره ژنتیک:
ریسک وقوع مجدد در هر بارداری برای والدینی که بچه مبتلا به بیماری آلبینیسم چشمی - پوستی با توارث اتوزوم مغلوب دارند، 25% می باشد. در صورتی که یکی از والدین مبتلا به بیمار آلبینیسم چشمی - پوستی با توارث اتوزوم مغلوب باشد و همسر او نیز ناقل ژن بیماری باشد، به احتمال 50% در هر بارداری احتمال فرزند بیمار می رود(مانند غالب کاذب[28]).
تشخیص قبل از تولد با توالی یابی DNA جنین که از نمونه های آمنیوسنتز و CVS بدست آمده است، امکان پذیر می باشد که بسته به نوع تیپی که در آن خانواده مشاهده شده است، ژن آن تیپ از بیماری در جنین بررسی می کنند. با فتوسکوپی (یک روش با ریسک بالا) از پوست جنین بیوپسی تهیه می کنند و فقدان ملانین در ملانوسیت پوست مورد بررسی قرار می گیرد. این روش یک روش تهاجمی و توصیه نمی گردد.
در مورد بیماران آلبینیسم توصیه به مراقبت از پوست با اجتناب کردن از در معرض خورشید ماندن برای مدت طولانی برای محافظت از پوست در برابر اشعه UV و کاهش ریسک ملیگنانسی[29] می شود. استفاده از لباس های مناسب و کرم های ضد آفتاب توصیه می گردد. برای مراقبت از چشم استفاده از عینک های آفتابی برای فتوفوبی و عینک های مناسب برای اصلاح دوربینی، نزدیک بینی و آستیگماتیس و جراحی برای اصلاح انحراف بینایی توصیه می گردد.
[1] Oculocutaneous albinism
[2] Ocular albinism
[3] Hermansky-Pudlak syndromes
[4] Chediak-Higashi syndrome
[5] Null
[6] Leaky
[7] Pink-eye dilution gene
[8] Tyrosinase-related protein-1 gene
[9] Fovea
[10] Black-browneumelanin
[11] Red-blond pheomelanin
[12] Tyrosinase-related protein 1
[13] Tyrosinase-related protein 2
[14] Melanosomal membrane protein
[15]Temporal fibers
[16] Alternating strabismus
[17] Hyperopia
[18] Myopia
[19] Amishalbinism
[20] Xanthous albinism
[21] Yellow-red pheomelanin
[22] Eumelanin
[23] Hypermetropia
[24] Posterior embryotoxon
[25] Hypopigmented streaks
[26] Ophthalmologic examination
[27] Hair bulb incubation assay
[28] Pseudodominance
[29] Malignancy
ژن FOXL2 دارای 1 اگزون و طول 7/2 kb می باشد. این ژن کد کننده پروتئین 376 اسید آمینه ای با دو دومین می باشد که عبارتند از دومین110 اسید آمینه ایForkhead DNA بایندینگ (باعث قرار گرفتن آن در خانواده فاکتورهای رونویسی Forkhead که در مراحل تکوین نقش مهمی دارند، شده است) و دومین پلی آلانین متشکل از 14 تکرار اسید آمینه مذکور که عملکرد این دومین ناشناخته است ولی در پستانداران بسیار حفظ شده می باشد.
پروتئین FOXL2 در بافت متعدد، از جمله پلک ها، تخمدان ها و غده هیپوفیز فعال است. این پروتئین به احتمال زیاد در رشد عضلات در پلک درگیر می باشد. قبل از تولد و در دوران بزرگسالی، پروتئین FOXL2 در تنظیم رشد و تقسیم (تکثیر) سلول های تخمدان تولید کننده هورمون به نام سلول های گرانولوزا فعالیت دارد. این پروتئین نیز در تجزیه چربی ها، هورمون های استروئیدی و مولکول های به طور بالقوه مضر به نام گونه های اکسیژن فعال در تخمدان نقش دارد. پروتئین FOXL2 همچنین نقش مهمی در کنترل مرگ سلولی (آپوپتوز) در تخمدان دارد.

شکل 1: نقش مهم پروتئین FOXL2 را در تکامل تخمدان نشان می دهد.
بر اساس تاثیر جهش های ژن مذکور بر روی پروتئین حاصله آنها را به هشت گروه A-I تقسیم بندی می کنند. گروه A-D پروتئین های ناقص را در بر می گیرند که عبارتند از: گروه A فاقد دومین Forkhead، گروه B دارای دومین Forkhead ناقص، گروه C دارای دومین Forkhead کامل و فاقد دومین پلی آلانین و گروه D دارای دو دومین مذکور کامل می باشد. در گروه E دو دومین کامل ولی به علت جهش Fram shift طول پروتئین بلندتر شده است. در گروه F چارچوب پروتئین به هم نمی خورد. گروه G دارای جهش بدمعنی می باشد. گروه H نوآرایی کروموزومی و گروه I سایر موارد هستند.
جایگاه کروموزومی:
این ژن در لوکوس 3q22.3 قرار دارد و جایگاه مولکولی آن از 138,944,224 باز تا 138,947,140 باز می باشد.

شکل 2: جایگاه کروموزومی ژن FOXL2 را بر روی کروموزوم 3 نشان می دهد.
تغییرات ژنی و اختلالات ژنتیکی
نام های دیگر ژن FOXL2
BPES
BPES1
forkhead transcription factor FOXL2
FOXL2_HUMAN
PFRK
از طریق پژوهش ژنتیکی به دیدگاه جدیدی که چگونه سیگار قادر به ایجاد سرطان در سطح وسیعی از اندام می شود، دست پیدا کردیم. این مطالعه ارتباط بین تعداد سیگار روزانه و تعداد جهش در DNA تومور را بررسی کرده است.
عواقب منفی برای سلامتی حاصل از سیگار کشیدن شناخته شده و به شدت بررسی شده است. حدود 6 میلیون نفر هر سال به علت بیماری های مرتبط با سیگار کشیدن می میرند. اگر این روند ادامه پیدا کند، با توجه به گزارش سازمان بهداشت جهانی[1] (WHO)، یک میلیارد مرگ و میر این قرن ناشی از مصرف دخانیات خواهد بود. سیگار کشیدن علت شناخته شده آسیب های جبران ناپذیر در اندام های مختلف است. همچنین موجب جهش از طریق مکانیسم های متفاوت در DNA می گردد. با این حال، روشن نیست که چگونه موجب انواع مختلفی از سرطان ها در قسمت های متفاوتی از بدن می شود. تا به امروز، ارتباط سیگار کشیدن با 17 نوع از سرطان مشخص شده است، اما مکانیزم های ژنتیکی مرتبط در ایجاد این سرطان ها پنهان باقی مانده اند.
محققان از موسسات ولکام سنگر و کینگز کالج لندن در انگلستان و آزمایشگاه ملی لوس آلاموس، NM، به تازگی بر روی ژنتیک سرطان های مرتبط با سیگار کشیدن مطالعه انجام دادند و نتایج خود را این هفته در مجله علوم منتشر کردند. در این تحقیقات که دقیق ترین مطالعه از نوع خود می باشد، دانشمندان DNA تومور 5000 بیمار را مورد بررسی قرار دادند. آنها نتایج بدست آمده از تومور افراد غیر سیگاری را با نتایج تومور افراد سیگاری مقایسه و تفاوت های ژنتیکی آن ها را شناسایی کردند. تجزیه و تحلیل این تومورها به آنها اجازه درک اثر انگشت مولکولی آسیب DNA مربوط به سیگار کشیدن را داد. این محققان قادر به مطالعه این جهش بخصوص و ارزیابی تعداد جهش در هر تومور بودند.
شمارش جهش تومور مربوط به دخانیات
این محققان قادر به اندازه گیری نرخ جهش به ازای هر سیگار بودند. آنها دریافتند که کشیدن یک پاکت سیگار در روز باعث ایجاد تعداد قابل پیش بینی جهش در ریه ها در طول یک سال می شود. دکترلودمینالکساندروف، از آزمایشگاه ملی لوس آلاموس. در این باره می گوید: قبل از این، ما شواهد بزرگی از اپیدمیولوژیک بین سیگار کشیدن و سرطان پیدا کرده بودیم اما در حال حاضر در این مطالعه، ما در واقع تغییرات کمی در DNA، به دلیل مصرف سیگار را اندازه گیری کردیم و نشان دادیم که افرادی که در روز یک بسته سیگار می کشند بطور میانگین 150 جهش اضافی در ریه های خود در هر سال ایجاد می کنند که این موضوع توضیح می دهد که چرا افراد سیگاری چنین خطر بالاتری برای ابتلا به سرطان ریه دارند.
این تیم همچنین یک تصویر واضح تری از اثرات سیگار بر جهش در DNA اندام های دیگر نیز ارائه داد. آنها دریافتند که یک بسته سیگار در روز منجر به:
97 جهش در هر سلول حنجره
39 جهش در هر سلول حلق
23 جهش در هر سلول دهان
18 جهش در هر سلول مثانه
6 جهش در هر سلول کبد
قبلا توضیح چگونگی تاثیر جهش بر روی اندام های بدن به غیر از ریه ها دشوار بود. این تحقیق جدید راه هایی که می تواند دخانیات موجب جهش در بافت ها و اندام های مختلف شود را کشف کرد. پروفسور دیوید فیلیپس از کالج کینگ لندن در این باره می گوید: جهش ناشی از آسیب مستقیم مواد سرطان زا موجود در دخانیات به طور عمده در اندام هایی که در تماس مستقیم با دود دخانیات هستند، مشاهده می شود. در مقابل، سلول های دیگر بدن از آسیب های غیر مستقیم رنج می برند، دخانیات به نظر می رسد که روی مکانیسم های کلیدی این سلول ها که به نوبه خود جهش زا هستند تاثیر می گذارد. دود سیگار از طریق پنج فرآیند مجزا قادر به صدمه زدن به DNA است. این گروه دریافتند که سیگار کشیدن قادر است موجب شتاب سرعت یک ساعت سلولی شود که با افزایش جهش ژنتیکی DNA همراه است.
نگاهی به تحقیقات آینده در مورد سرطان
این محققان با برخی از نتایج شگفت زده شدند مانند سرطان های مرتبط با سیگار کشیدن پیچیده تر از آنچه قبلا تصور می کردند، هستند. پروفسور سر مایک استراتون از موسسه ولکام سانگر در این باره می گوید: این مطالعه درباره سیگار کشیدن به ما نشان می دهد که با جستجو در DNA سرطان ها می توان سرنخ های جدید درباره چگونگی پیشرفت سرطان پیدا کرد و در نتیجه به طور بالقوه می توان راه های جلوگیری از آنها را کشف کرد.
اخبار پزشکی امروز به تازگی از دکتر الکساندروف پرسید که آیا آنها برنامه ای برای انجام تحقیقات بیشتر در یک مورد دارند؟
او پاسخ داد: این مطالعه نشان داده است که آنالیز ملکولی بیماران سرطانی می تواند برای شناسایی مکانیسم هایی که توسط آنها مواد سرطان زا مختلف موجب سرطان می شوند، مورد استفاده قرار گیرد. ما در حال برنامه ریزی مطالعات آینده برای کشف کردن مکانیسم هایی که بوسیله آنها عوامل دیگر اپیدمیولوژیکی شناخته شده سرطان زا موجب سرطان می شوند، هستیم. برای مثال، ما در حال حاضر کار بر روی روشن ساختن مکانیسم هایی هستیم که چاقی توسط آنها باعث بروز سرطان می گردد.
نتایج فعلی نقطه عطفی در طول مسیر درک چگونه سرطان های مرتبط با سیگار کشیدن تاثیر منفی بر DNA دارند. هنوز هم مطالب زیادی وجود دارد که باید بدانیم، اما تحقیقات مانند این در سطح مولکولی به طور پیوسته ما را به درک و پیدا کردن راه های جلوگیری از سرطان نزدیک می کند.
Wellcome Trust Sanger Institute news release, accessed 3 November 2016 via EurekAlert.
[1] World Health Organization
جابجایی[1]انتقال ماده ژنتیکی از یک کروموزوم به کروموزوم دیگر است. جابجایی متقابل زمانی اتفاق می افتد که یک شکست در هر کدام از دو کروموزوم رخ دهد و قطعات آنها با هم مبادله و کروموزوم های جدیدی ایجاد نمایند. جابجایی رابرت سونی[2] نوع خاصی از جابجایی متقابل است که در آن نقاط شکست در یا نزدیک سانترومر دو کروموزوم آکروسانتریک قرار می گیرد.

جابجایی متقابل
یک جابجایی متقابل شامل شکست در حداقل دو کروموزوم و تبادل قطعات آنها است. معمولا عدد کروموزومی 46 حفظ می شود و اگر قطعات مبادله شده تقریبا هم اندازه باشند، تنها بوسیله مطالعات دقیق نواربندی کروموزومی یا FISH قابل شناسایی خواهند بود. در کل جابجایی های متقابل برای هر خانواده ناقل آن اختصاصی هستند اما بدلایل ناشناخته، جابجایی متقابل متعادل در بازوهای بلند کروموزوم های 11 و 22 نسبتا شایع هستند. شیوع کلی جابجایی متقابل در جمعیت عمومی تقریبا 1 در 500 می باشد.
تفکیک در میوز
اهمیت جابجایی های متعادل در رفتار آنها در میوز نهفته است، یعنی زمانی که می توانند طوری تفکیک یابند که عدم تعادل کروموزومی زیادی ایجاد کنند. این عمل می تواند منجر به خاتمه حاملگی در مراحل ابتدایی گردد و یا اینکه به تولد کودکی با چند ناهنجاری بیانجامد. این مشکلات در میوز بدین دلیل بوجود می آیند که کروموزوم دارای جابجایی نمی توانند برای تشکیل بی والانت ها بطور طبیعی با هم جفت شوند. در عوض آنها خوشه ای به نام تتراوالانت پاکی تن شکل می دهند. نکته قابل توجه آن است که هر کروموزوم با ماده همولوگ خود در تتراوالانت هم ردیف می شود.
شکل 1: نمایشگر تتراوالانت است.
تفکیک 2:2 وقتی که کروموزوم های تشکیل دهنده تتراوالانت طی مراحل بعدی میوز 1 می خواهند جدا شوند، می توانند به چند روش مختلف تفکیک شوند. اگر کروموزوم ها به صورت یک در میان به یک گامت تفکیک یابند، گامت یک مجموعه هاپلوئید طبیعی یا متعادل را دریافت خواهد کرد و با انجام لقاح رویان یا دارای کروموزوم های طبیعی خواهد بود و یا اینکه بازآرایی متعادل خواهد داشت. اما اگر کروموزوم های مجاور باهم به یک گامت تفکیک یابند حتما گامتی حاصل خواهد شد که مجموعه کروموزومی نامتعادل را کسب کرده است.
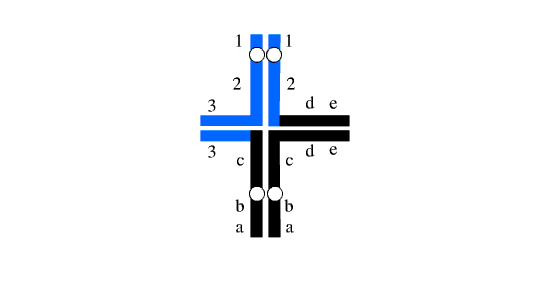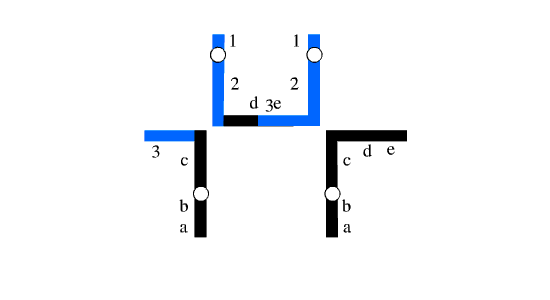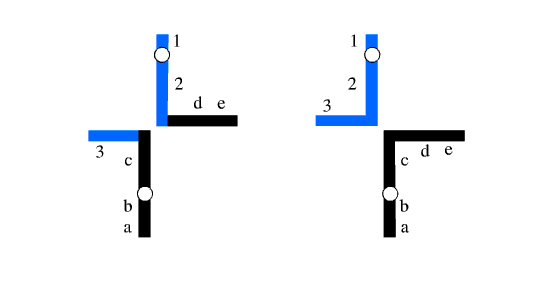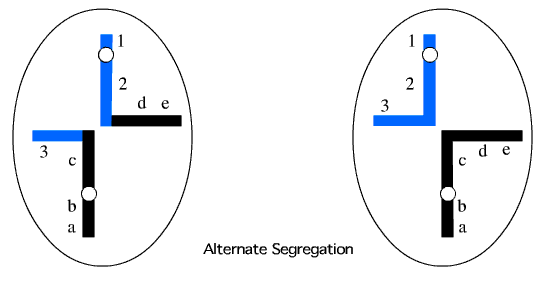
شکل 2: یک مجموعه هاپلوئیدی دارای کروموزوم های طبیعی و مجموعه دیگر دارای کروموزوم های دارای جابجایی هستند.
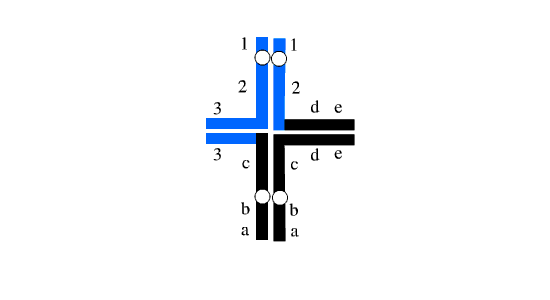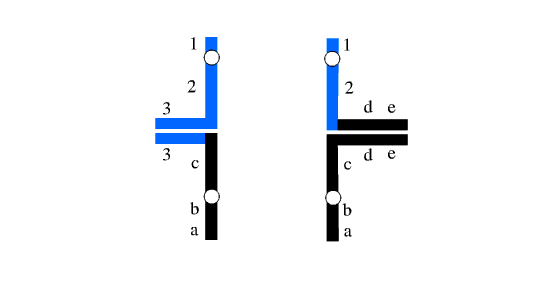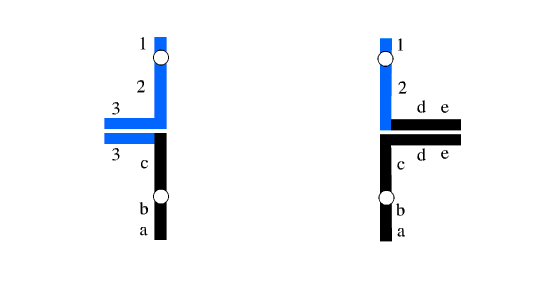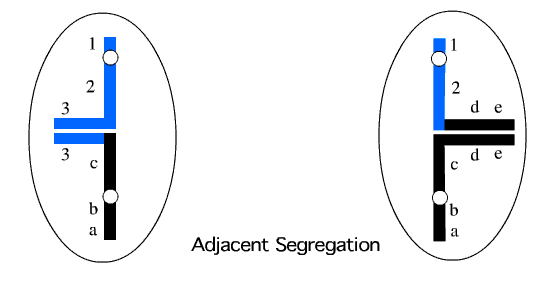
شکل 3: هر دو مجموعه هاپلوئیدی دارای مجموعه کروموزومی نامتعادل هستند.
تفکیک 1:3 احتمال دیگر این است که سه کروموزوم به یک گامت دیگر تفکیک یابند. چنین حالتی گاها تریزومی سه گانه[3] نامیده می شود. تمام انواع تفکیک شدگی های ناجور منجر به خاتمه بارداری در مراحل اولیه بارداری می شود. متاسفانه تریزومی سه گانه نسبت به کروموزوم 22 مشتق شده (ناشی از جابجایی متقابل کروموزوم های 11 و 22) موجب بیماری شدیدی همراه با ناهنجاری های مادرزادی و مشکلات شدید آموزشی می شود.

شکل 3: تفکیک 1:3 به هر سه نوع مختلف ممکن است رخ دهد که می توان سه نوع متفاوت مونوزومی و سه نوع متفاوت تریزومی سه گانه ایجاد نماید.
ریسک جابجایی های متقابل
وقتی که با فردی ناقل جابجایی متعادل مشاوره می شود، توجه به بازآرایی ویژه موجود ضروری است تا مشخص شود که آیا بازآرایی می تواند منجر به تولد یک بچه غیر طبیعی شود یا نه. این ریسک معمولا بین 1 تا 1-% می باشد. برای ناقلین جابجایی 22:11 این ریسک 5% نشان داده شده است.
جابجایی های رابرت سونی
جابجایی رابرت سونی[4] در اثر شکست دو کروموزوم اکروسانتریک (شماره های 13 و 14 و 15 و 21و 22) در / یا نزدیک سانترومر آنها و متعاقب آن چسبیدن بازوهای بلند آنها بوجود می آید. این پدیده را ادغام سانترومری[5] نیز می گویند. بازوهای کوتاه دو کروموزوم از بین می روند، با این حال از بین رفتن آنها اهمیت بالینی ندارد زیرا آنها فقط حاوی ژن های RNA های ریبوزومی هستند و کپی های زیادی از آنها در کروموزوم های آکروسانتریک ذیگر وجود دارند. عدد کل کروموزوم ها به 45 کاهش می یابد. چون ماده ژنتیکی که حائز اهمیت باشد از بین نمی رود و با بدست نمی آید، لذا از لحاظ عملکردی یک بازآرائی متعادل می باشد. بروز کلی جابجایی های رابرت سونی در جمعیت عمومی تقریبا 1 در 1000 است که تاکنون شایغترین آنها اتصال بازوهای بلند کروموزوم 13 و 14 (13q14q) بوده است.

تفکیک در میوز
مثل جابجایی های متعادل، اهمیت جابجایی رابرت سونین نیز در رفتار آنها در میوز نهفته است، به عنوان مثال یک ناقل جابجایی 14q21q گامت های با محتوای زیر را می تواند تولید کند:
در حالت اول: یک مجموعه کامل کروموزومی (یعنی یک کروموزوم 14 و یک کروموزوم 21 طبیعی) و در مقابل یک مجموعه متعادل کروموزومی (یعنی یک کروموزوم با جابجایی 14q21q)

در حالت دوم: یک مجموعه کروموزومی نامتعادل که دارای دو کروموزوم دارای دو کروموزوم دارای جابجایی و یک کروموزوم 21 طبیعی است. این گامت رویان لقاح یافته ای را بوجود می آورد که دارای سندرم داون است و در مقابل یک مجموعه کروموزومی نامتعادل دارای یک کروموزوم 14 و فاقد کروموزوم 21

حالت سوم: یک مجموعه کروموزومی نامتعادل دارای یک کروموزوم 21 و فاقد یک کروموزوم 14 و در مقابل یک مجموعه کروموزومی نامتعادل حاوی کروموزوم دارای جابجایی و یک کروموزوم 14 طبیعی

سه ترکیب آخر به ترتیب زیگوت های با منوزومی 21، مونوزومی 14 و تریزومی 14 بوجود می آورند که تمامی این ترکیبات در مراحل ابتدایی حاملگی محکوم به سقط هستند.
سندرم داون ناشی از جابجایی:
اهمیت اصلی جابجایی رابرت سونین در ایجاد استعداد برای تولد بچه های با سندرم داون است که در نتیجه به ارث بردن دو عدد کروموزوم 21 (هر کدام از یک والد) و یک کروموزوم 21 اضافی ناشی از جابجایی بوجود می آیند. عواقب بالینی آن درست مثل تریزومی 21 آزاد است. اما بر خلاف تریزومی 21 آزاد والدین بچه مبتلا به سندرم داون حاصال از جابجایی، اگر یکی از آنها ناقل بازآرایی به شکل متعادل باشد ریسک نسبتا بالاتری برای داشتن بچه های مبتلا به داون دارند.
در نتیجه انجام آنالیز کروموزومی برای یک بچه مبتلا به سندرم داون نه تنها برای تایید تشخیص بلکه برای شناسایی بچه هایی که دارای جابجایی هستند حائز اهمیت است. تقریبا در دو سوم بچه های مبتلا به سندرم داون ناشی از جابجایی به علت رخداد جدید[6] در بچه است اما در یک سوم باقی مانده، یکی از والدین ناقل خواهد بود. بستگان دیگر نیز ممکن است ناقل باشند. بنابراین لازم است برای شناسایی تمام افراد بزرگسال ناقل موجود در این خانواده ها تلاش شود، تا از خطر داشتن بچه های مبتلای بعدی آگاه شوند. این عمل را گاها ردگیری جابجایی یا تعقیب[7] می گویند.
خطرات جابجایی رابرت سونین:
مطالعات نشان داده است که زنان ناقل هر کدام از جابجایی رابرت سونین 13q21q یا 14q21q تقریبا 10% در معرض خطر داشتن بچه مبتلا به داون قرار دارند، اما در مردان ناقل این جابجایی ها خطر بین 1-3% است. بداقبالی فرد ناقل جابجایی رابرت سونین 21q21q در این است که گامت های وی برای کروموزوم 21 یا نولی زومی و یا دی زومی است. در نتیجه تمام بارداری های یا با سقط خودبخودی همراه است و یا منجر به فرزند مبتلا به داون خواهد شد. این یکی از وضعیت های بسیار نادر است که در آن زاده ها به احتمال 50% در معرض خطر داشتن یک ناهنجاری هستند. نمونه های دیگر عبارتند از بچه های مادر مبتلا به فنیل کتنوری، والدینی که هر دو هتروزیگوت برای یک اختلال غالب اتوزومی هستند، و والدینی که هر دو در یک ژن عامل اتوزومی مغلوب هموزیگوت هستند، مثل ناشنوایی خسی عصبی.
[1] Translocations
[2] Robert Sonian
[3] Tertiary fusion
[4] Robertsonian translocation
[5] Centric fusion
[6] Denovo
[7] Chasing
ناهنجاری های ساختاری کروموزومی ناشی از شکست و الحاق مجدد قسمتی از کروموزوم می باشد که ممکن است این بازآرایی متعادل به این معنا که ماده ژنتیکی از دست نرفته و یا بدست نیامده است و یا نامتعادل به این معنا که مقدار ماده ژنتیکی دچار حذف و اضافه شده است. بازآرایی های متعادل عموما بی ضرر هستند به استثنای مواردی که نقاط شکسته شده به عملکرد یک ژن آسیب برساند و یا در بیان ژن مجاور تاثیر بگذارد. انواع این ناهنجاری ها عبارتند از:
Insertions
Invertion
Ring chromosomes
حذف:
یک حذف شامل از دست رفتن بخشی از یک کروموزوم بوده که منجر به منوزومی نسبت به آن قسمت از کروموزوم می گردد. یک حذف بزرگ معمولا با بقا سازگار نیست و به عنوان یک قانون کلی هر حذفی که منجر به از دست رفتن بیش از 2% کل ژنوم هاپلوئید شود، کشنده است. در حال حاضر مشخص شده است که حذف ها در دو سطح وجود دارند که عبارتند از حذف بزرگ که زیر میکروسکوپ قابل شناسایی است مانند سندرم های ولف هیرش هورن[1] و فریاد گربه[2] که به ترتیب قسمتی از انتهای بازوی کروموزوم های 4 و 5 در آنها از بین رفته است. این اواخر ریز حذف های خارج از حد تفکیک میکروسکوپ به کمک روش های سیتوژنتیکی پرو متافازی با تفکیک بالا شناسایی شده و با مطالعات FISH افزایش یافته اند. برای مثال مشخص شده است که چند بیماری از قبیل سندرم های پرادرویلی [3] و آنجلمن[4] که قبلا علت آن ها ناشناخته بود میتوانند در اثر ریز حذف ها بوجود آیند.
.gif)
[1] Wolf-Hirschhorn
[2] Cri du chat
[3] Prader-willi
[4] Angelman
Muenke syndrome یک بیماری است که با بسته شدن زودرس استخوان های جمجمه[1] در کودکی همراه است که بر روی شکل سر و صورت تاثیر می گذارد. این سندرم در حدود یک در هر 30000 نوزاد رخ می دهد و در حدود 8 درصد موارد کرانيوسينوستوز را شامل می شود. نام های دیگر این سندرم عبارتند از FGFR3-associated coronal synostosis و Muenke nonsyndromic coronal craniosynostosis
ژنتیک بیماری:
جهش در ژن FGFR3 در لوکوس 4p16 موجب این بیماری می گردد و توارث این بیماری اتوزومال غالب است. ژن FGFR3 کد کننده پروتئینی به نام گیرنده فاکتور رشد فیبروبلاست 3 می باشد که در توسعه، رشد و نگهداری از استخوان و بافت مغز نقش دارد. تنها یک جهش در ژن FGFR3 مسئول ایجاد سندرم Muenke است و آن Pro250Arg می باشد. این جهش باعث می شود که پروتئین FGFR3 بیش از حد نرمال فعالیت کند، که منجر به تداخل در رشد استخوان ها و به هم پیوستن قبل از موعد استخوان های جمجمه می گردد.
علایم بالینی:
بسیاری از افراد مبتلا به این اختلال دارای یک همجوشی زودرس در استخوان های جمجمه در امتداد درز تاجی[2] هستند که این خط رشدی از یک گوش تا گوش دیگر امتداد دارد. این همجوشی می تواند دوطرفه یا یکطرفه باشد ولی میزان رخداد دوطرفه آن بیشتر است. البته قطعات دیگر جمجمه ممکن است نیز در شکل غیر طبیعی جمجمه نقش داشته باشند. در اکثریت بیماران برجستگی تمپورال[3]، افزایش فاصله بین دو چشم، پتوزیس، استرابیسم، ابروی کمانی، پهن شدن استخوان های گونه و شکاف لب یا کام دیده می شود. حدود 5 درصد از افراد مبتلا دارایسر بزرگ[4] هستند. بعلاوه افراد مبتلا به این بیماری ممکن است دارای اختلالات خفیف در دست و پا مانند براکی داکتیلی، شست دست و پا پهن، انگشتان مخروطی و کلینوداکتیلی باشند. از دست دادن شنوایی در حدود 33 تا 100 درصد بیماران مشاهده می شود. اکثر افراد مبتلا به این بیماری از هوش طبیعی برخور دارند، اما تاخیر و ناتوانی در یادگیری ممکن است، دیده شود. علائم و نشانه های این سندرم در میان مبتلایان بسیار متفاوت است (بیان متنوع). برخی از این علایم با مبتلایان به سایر سندرم ها که با کرانيوسينوستوز همراهی دارند، همپوشانی دارند. بین 6 و 7 درصد از افراد مبتلا دارای جهش در ژن مرتبط با سندرم Muenke هیچگونه علایمی از بیماری را بروز نمی دهند(نفوذ ناکامل). نفوذ این بیماری بین زنان 87 درصد و بین مردان 76 درصد است.

شکل1: یک دختر 24 ماهه است که علایم اگزوفتالموس ملایم[5] و فلاگیو- براکی سفالی[6] در تصویر بخوبی قابل مشاهده است.
راه های تشخیص:
CT اسکن و رادیولوژی برای ارزیابی نشانه های بیماری در جمجمه می توانند کمک کننده باشند. سونوگرافی در دوران بارداری می تواند یکی از راه های تشخیص جنین های مبتلا باشد. انجام تست ژنتیک مربوطه که بررسی وجود جهش Pro250Arg در ژن FGFR3 تست تاییدی این بیماری است.

شکل2: درز تجی هر دو طرف جمجمه بسته می باشد.
مشاوره ژنتیک:
Muenke syndrome دارای الگوی توارثی اتوزومال غالب با نفوذ ناکامل و بیان متنوع است. اگر والدین فاقد جهش بیماری زا در ژن FGFR3 خود باشند فرزند بیمار ایشان بر ارث موزاییسم ژرم لاین در پدر و مادر و یا جهش جدید مبتلا شده است. هر فرزند فرد مبتلا به Muenke syndrome به احتمال 50٪ به این بیماری مبتلا می شود اما با در نظر گرفتن نفوذ ناکامل این بیماری این مقدار کمتر می گردد. در این خانواده ها برای حاملگی در معرض خطر تشخیص پیش از تولد توسط تست ژنتیک بر روی نمونه CVS در هفته 12 بارداری امکان پذیر است.
مدیریت بالینی:
کودکان مبتلا باید در سن 3 الی 6 ماهگی مورد جراحی ترمیمی کرانيوسينوستوز قرار گیرند. این جراحی علاوه بر بهبود ظاهر مبتلایان موجب کاهش عوارضی که در اثر افزایش فشار داخل جمجمه ای مانند تغییرات رفتاری ایجاد می شدند نیز می گردد.
[1] Craniosynostosis
[2] Coronal suture
[3] Temporal bossing
[4] Macrocephaly
[5] mild exophthalmos
[6] plagio-brachycephaly
افزایش بیان پروتئین Human Epidermal Growth Factor Receptor - HER2 در نتیجه تکثیر ژنی است که منجر به افزایش مولکول های علامت دهنده رشد و در نتیجه رشد تومورها و پیشرفت سریع تر سرطان سینه می گردد. تست Her2 در بیماران مبتلا به سرطان سینه برای تعیین پیشرفت بیماری و تشخیص مناسب بودن درمان هرسپتین[1] انجام می گیرد. این مسئله که هرسپتین باید به سلول های HER2 مثبت منحصر شود بسیار مهم است زیرا علاوه بر گران بودن با توکسیتی قلبی نیز همراهی دارد. برای تومور های HER2 منفی استفاده از هرسپپین نه تنها سودمند نمی باشد بلکه زیان بار نیز هست. تست ها معمولا روی نمونه بیوپسی انجام می گیرند. با استفاده از روش Immunohistochemistry یا IHC مقدار پروتئینHer2 موجود در نمونه اندازه گیری می شود. تکنیک Fish برای اندازه گیری تعداد کپی های موجود از این ژن مورد استفاده قرار می گیرد. برای تشخیص مبتلایان واجد شرایط برای درمان با هرسپتین در مرحله اول با استفاده از روش ایمونوهیستوشیمی یا IHC مقدار پروتئین HER2 موجود در نمونه تومور اندازه گیری می شود. در مواردی که تست IHC آنها منفی است، نیاز به اقدام دیگری در این مورد نمی باشد. ولیکن اگر نتیجه این آزمایش کمتر از 3 مثبت باشد مثبت بودن آن بایستی با آزمایش FISH اینترفازی مورد تایید قرار بگیرد.

شکل1: افزایش بیان بالای پروتئین Her2 که ناشی از تکثیر ژن مربوطه واقع در کروموزوم 17
تکنیک FISH برای اندازه گیری دقیق تعداد کپی های موجود از این ژن مورد استفاده قرار می گیرد. بسیاری از پزشکان ابتدا IHC را درخواست می دهند در صورتیکه این تست نتواند مثبت بودن HER2 را تعیین کند بیمار را برای انجام تست FISH معرفی می نمایند.

شکل 2: نمایی از مکانیسم انجام تست FISH HER2
برای انجام آزمایش FISH برش های بسیار نازکی از بلوک پارافینی نمونه بیوپسی بیمار روی لام قرار گرفته و با پروب های فلوئورسنت مخصوص ژن HER2 و سـانترومـر کروموزوم 17با دو رنگ متفاوت سبز و قرمز هیبرید شده و سیگنال ها شمارش گردیده و با توجه به نسبت معینی از سیگنال پروب HER2 به سیگنال پروب سانترومری وضعیت سلول ها از نظر تکثیر ژنی مورد ارزیابی قرار می گیرد.
شکل 3: نتیجه آزمایش FISH مربوط به یک بیمار HER2 مثبت
[1] Herceptin therapy
سرطان سینه سه گانه منفی یک بیماری تهاجمی است که چالش های بالینی زیادی را در بر دارد. زیست شناسی این بیماری در مقایسه با بسیاری از سرطان های دیگر کمتر شناسایی شده است و نیاز فوری برای ابزارهای پیش آگهی های جدید و درمان آن وجود دارد. در حال حاضر، یک مطالعه جدید نشان می دهد غربالگری بیماران برای گیرنده پرولاکتین ممکن است ما یک گام در این راه به جلو ببرد.
این مطالعه کاری از محققان دانشگاه مک گیل در کانادا است، که یافته های خود را در مجله گزارش های علمی به چاپ رسانند. تشخیص سرطان سینه سه گانه منفی به این معنی است که تومور فاقد سه نوع گیرنده شناخته شده شایع که موجب رشد بیشتر تومور سرطان سینه می شوند، است. این گیرنده ها عبارتند از: گیرنده های استروژن، پروژسترون و فاکتور رشد اپیدرمی انسانی گیرنده [1]2 (HER2). حدود 15 درصد از مبتلایان سرطان سینه را سرطان سینه سه گانه منفی تشکیل می دهد. متاسفانه، آن است که معمولا با میزان بالایی از عود مجدد بیماری و بهبودی کم بیماری همراه است.
سهاد علی، استادیار طب و نویسنده ارشد این مطالعه جدید، توضیح می دهد که درمان سرطان سینه سه گانه منفی بسیار دشوار است. در مقایسه با انواع دیگر سرطان های سینه، راه های درمانی برای این نوع سرطان محدودتر است و بیماران اغلب باید تحت شیمی درمانی تهاجمی و پیش آگهی ضعیف قرار بگیرند.
مطالعات که بر روی روند سرطان سینه سه گانه منفی انجام شده است نشان می دهد که این بیماری یک بیماری نیست بلکه طیف وسیعی از سرطان های گوناگون می باشد که در بیماران مختلف متفاوت عمل می کند.به عنوان مثال، یک مطالعه که در سال 2011 بر روی بیان ژن انجام شد، پیشنهاد کرد حداقل شش زیر گروه از سرطان پستان سه گانه منفی وجود دارد.
سلول های فاقد گیرنده پرولاکتین تهاجمی تر می شوند.
پروفسور علی و همکارانش اذعان دارند که با وجود همه ی این پیشرفت ها نیاز به درک بهتر زیست شناسی سرطان سینه سه گانه منفی و مسیرهای مولکولی درگیر در آن وجود دارد.
برای این مطالعه، آنها داده های 580 زن مبتلا به سرطان سینه سه گانه منفی را آنالیز کردند و دریافتند که بیماران دارای بیان گیرنده پرولاکتین در تومورهایشان هستند بقایشان طولانی تر است.آنها همچنین دریافتند که هورمون پرولاکتین توانایی تقسیم و تشکیل تومورهای جدیدی سلول های سرطانی را کاهش می دهد. در نتیجه سرطان کمتر تهاجمی می شود. با استفاده از یک مدل حیوانی بالینی، آنها دریافتند که سلول های سرطانی در تومورهای که فاقد گیرنده پرولاکتین شدند، در مقایسه با کسانی که در تومورهایشان بیان گیرنده پرولاکتین را دارند، نه تنها تهاجمی تر هستند بلکه آنها با سرعت بیشتری تقسیم می شوند.
پروفسور علی اشاره می کند که نقش پرولاکتین در سرطان سینه هنوز به طور کامل مشخص نیست. اما این هورمون موجب محافظت مادران شیرده در برابر این بیماری می گردد. پزشکان به بیماران در معرض خطر بالای سرطان سینه مصرف این هورمون را توصیه می کنند. همچنین وی می افزاید که یافته های وی از این مطالعات حمایت می کند که پرولاکتین دارای اثر محافظتی در برابر سرطان سینه دارد. تغذیه با شیر مادر یک راه طبیعی برای تولید هورمون در مقادیر زیاد است که به خوبی می تواند خطر ابتلا زنان به این بیماری را کاهش می دهد.
در نهایت پروفسور علی بیان می کند که نتایج این مطالعه نشان می دهد که غربالگری برای گیرنده پرولاکتین مشخص کند که برای کدام بیمار درمان با پرولاکتین به تنهایی و برای کدام بیمار درمان با پرولاکتین بعلاوه شیمی درمانی ملایم سودمندتر است. ما فکر می کنیم این می تواند یک مسیر انقلابی برای پیشرفت در درمان های جدید برای سرطان سینه باشد.(1)
1. Lopez-Ozuna VM, Hachim IY, Hachim MY, Lebrun JJ, Ali S. Prolactin Pro-Differentiation Pathway in Triple Negative Breast Cancer: Impact on Prognosis and Potential Therapy. Scientific reports. 2016;6:30934.
[1] Human epidermal growth factor receptor 2
این بیماری در واقع یک اختلال همراه با ناهنجاری مادرزادی متعدد است که به طور عمده بر غدد و کانال های اشکی، غدد و کانال های بزاقی، گوش، دندان ها، و بخش دیستال اندام ها اثر می گذارد. بیماری Lacrimo-Auriculo-Dento-Digital Syndrome در سال 1973 برای اولین بار توسط Hollister و همکارانش توصیف شد و تاکنون 60 مورد از آن گزارش شده است. این بیماری به نام دیگر Levy-Hollister Syndrome نیز خوانده می شود.
ژنتیک بیماری:
توارث این بیماری اتوزومال غالب است و بیان متنوع در مبتلایان دیده می شود. جهش در ژن FGFR3 واقع در لوکوس 4p16.3، ژن FGFR2 واقع در لوکوس 10q26.13 و ژن FGF10 واقع در لوکوس 5p12 موجب این بیماری می شود. به بیان دیگر این بیماری در اثر جهش در دومین تیروزین کیناز ژن های کد کننده گیرنده فاکتور رشد فیبروبلاست 2 و 3 و همچنین در اثر جهش در ژن کدکننده لیگاند FGFR بوجود می آید. البته جهش در ژن FGF10 منجر به آپلازی اشکی و بزاقی غدد[1] نیز شود. (هتروژنی آللی)
صفات بالینی:
این بیماران در واقع یک اکتودرمال دیسپلازی است و دارای علایمی همچون دیسپلازی ناخن یا ناخن هایی رنگ پریده، شیاردار و ضخیم، هیپوپلازی میانه صورت یا میانه صورت کوتاه و پهن، تله کانتوس[2]،آپلازی یا هیپوپلازی غدد اشکی و کانال آن، ناتوانی در تولید اشک، نوک بینی پهن[3] و بینی با پره های بزرگ[4]، تیغه میانی غیر طبیعی[5]، فیلتروم بلند[6]، دندان های مخروطی شکل[7]، میکرودنشیا[8]، نقص در مینای دندان[9]، بی رنگی دندان ها[10]، open bite، قرارگیری نامناسب دندان ها، الیگودنشیا[11]، فقدان دندان[12]، پوسیدگی دندان[13]، ناهنجاری در غدد بزاقی[14]، هیپوتونی، قرارگیری گوش پایین تر از حد طبیعی، گوش های برجسته و به سمت جلو یا گوش خفاشی[15]، گوش فنجانی، فقدان گوش خارجی[16]، میکروتیا[17]، هلیکس پهن و ضخیم، هیپوپلازی آنتی هلیکس[18]، ناشنوایی حسی – عصبی، ناشنوایی هدایتی، سین داکتیلی، پلی داکتیلی پراگزیال[19]، کلینوداکتیلی، انگشتان دوکی شکل[20]، فقدان شست یا کوتاهی و یا هیپوپلازی در آن، شست دو شاخه یا پهن، انگشت شست سه بندی[21]، انگشت شست پا دو شاخه یا پهن، مشکل در بلع غذا[22]،کلیه منفرد، آژنزی کلیه[23]، دارای ساعد کوتاه، فقدان یا هیپوپلازی زند زیرین، سینوستوز زند زبرین و زیرین[24]، بدشکلی ریه و ژنیتال هستند.

شکل 1: پسر 13 ساله مبتلا یه LADD در قسمت A پپتور دوطرفه، تله کانتوس و بینی با پره های پهن و در قسمت B گوش فنجانی شکل با لوب بیرون زده نشان داده شده است.

شکل 2: a) کلینوداکتیلی در انگشت پنجم مشاهده می شود. b) کوتاهی ساعد و وجود فقط سه انگشت در هر دو دست.

شکل 3: a) هیپودونشیا و میکرودونشیا در دو فرد مبتلا
راه های تشخیصی:
در سونوگرافی جنین های مبتلا الیگوهیدروآمینوس مشاهده می شود. CT اسکن می تواند در تشخیص ناهنجاری ها آترزی های مختلف در جمجمه که موجب ناشنوایی می گردد و آترزی کوآن[25] و آترزی غدد اشکی و مجرای آن را مشاهده کرد. انجام تست ژنتیک در مبتلایان که توالی یابی ژن های FGFR2، FGFR3 و FGF10 می باشد تست تاییدی برای تشخیص این بیماری است.

شکل 3: A) عکس CT اسکن با وضوح بالا است که اختلالات استخوان تمپورال. بخش حفرات راست و چپ پرده صماخ را در یک پسر 13 ساله نشان می دهد. در سمت راست، تنها malleus ابتدایی دیده می شود. استخوانچه های دیگر وجود ندارد. در سمت چپ، استخوان سندانی و malleus حاضر هستند، اما آنها هر دو ابتدایی هستند. استخوان رکابی نیز در حال حاضر در این سمت وجود دارد. B) آترزی کوآن در ان دیده می شود. C) آترزی دوطرفه غدد اشکی نشان می دهد که با پیکان محل آنها مشخص شده که در فرد وجود ندارد.
مشاوره ژنتیک:
در صورتیکه یکی از والدین به این بیماری مبتلا باشد و دیگری سالم باشد احتمال داشتن فرزند مبتلا 50% است. البته در افراد مبتلا بدون هیچ سابقه خانوادگی از این بیماری جهش جدید رخداده است که به این ترتیب ریسکی برای فرزندان بعدی والدین وی در پی ندارد.
تشخیص پیش از تولد آنالیز ژن های مذکور در نمونه های CVS و آمینوسنتز است که برای زوجینی که یکی از آنها یا هر دو به این بیماری مبتلا هستند توصیه می شود. نکته ای که باید به آن اشاره کرد این است که باید مانند سایر اختلالات ژنتیکی قبل از بارداری جهش بیماری زا والدین شناسایی شده باشند تا در در زمان کوتاه تر و با دقت بیشتر بتوان سلامت جنین را مورد بررسی قرار داد.
[1] Aplasia of the lacrimal and salivary glands
[2] Telecanthus
[3] Broad nasal tip
[4] Flared nostrils
[5] Abnormal columella
[6] Long philtrum
[7] Tooth crown shape abnormality
[8] Microdontia
[9] Enamel hypoplasia
[10]Tooth discoloration
[11] Oligodonita
[12] Andontia
[13]Dental caries
[14]Abnormality of salivary glands
[15]Bat ear
[16]Anotia
[17]Microtia
[18]Antihelix hypoplastic
[19] Polydactyly preaxial
[20]Spindle shape
[21]Ttriphalangeal thumb
[22] Dysphagia
[23]Renal agenesis
[24] Radio-ulnar synostosis
[25] Choanal atresia
درمان بیماری کرون به علت دوره و شدت متفاوت بیماری بسیار دشوار است. تحقیق انجام شده توسط دانشگاه پزشکی شمال کارولینای دو نوع زیرتایپ را در این بیماری شناسایی کرد که موجب بیان متفاوت ژن ها و صفات بالینی متفاوت می شوند که ممکن است پاسخ تفاوت زیاد در پیشرفت بیماری بین بیماران باشند.
بیماری کرون یک بیماری مزمن است که باعث التهاب دیواره دستگاه گوارش می شود. تقریبا 1 میلیون نفر در ایالات متحده به این بیماری مبتلا هستند. در حالی که هیچ درمانی برای کرون وجود دارد، درمان با داروهای ضد التهابی و سرکوبگر سیستم ایمنی بدن می تواند تا حدودی کمک به بهبود علائم نمایند. حدود 70 درصد از افراد مبتلا به کرون در نهایت نیاز به عمل جراحی برای حذف بخش های آسیب دیده دستگاه گوارش و به هم متصل کردن بخش های سالم را دارند، و حدود 39 درصد به جراحی مجدد نیاز دارند. جراحی نیز ممکن است موجب ایجاد فیستول و آبسه گردد.
یافته های این مطالعه در مجله روده[1] منتشر شده است. این مطالعه بر دانش زیست شناسی بیماری کرون موجود بنا شده است، ونتایج آن به طور بالقوه می تواند به استراتژی های موثر تر و درمان های شخصی برایهدف قرار دادن شرایط گوارشی ناتوان کننده منجر شود.
دکتر شهزاد زهرا شیخ، استادیار بخش پزشکی و ژنتیک دانشگاه کارولینای شمالی (UNC) می گوید: یک الگوی واحد درمانی برای همه بیماران کرون به نظر نمی رسد، کارایی داشته باشد.دلیل این که تنها یک زیر مجموعه از بیماران به درمان استاندارد پاسخ می دهند وجود اختلافات زیر تیپی است، در حالی که بقیه بیماران با این درمان نتیجه مثبتی نمی گیرند.
دکتر شیخ و تیمش نمونه بافت روده بزرگ 21 بیمار کرون که سالم و غیر ملتهب و مورد عمل جراحی قرار گرفته بودند را مورد بررسی قرار دادند. سپس آنها دو الگوهای بیان ژنی مشخص و کاملا مجزا را در میان نمونه پیدا کردند.
دکتر تری فری دانشیار گروه ژنتیک و بیولوژی UNC درباره این پژوهش می گوید: اگر چه ما در سطح مولکولی تفاوت آشکاری بین نمونه بیماران کرون و افراد سالم مشاهده کردیم ولیکن ما یک تفاوت آشکارتری در سطح مولکولی بین این دو زیر مجموعه از نمونه کرون که بافت سالم از بیماران کرون و نمونه ملتهب از بیماران کرون بودند نیز مشاهده کردیم.
علاوه بر تفاوت بیان ژنی بین نمونه های بیوپسی روده بزرگ، دکتر سیمون استادیار از گروه ژنتیک UNCمعتقد است که بسیاری از بیان ژن ها بین دو نوع زیر تایپ کرون متفاوت هستند و می توانند نشانگر خوبی برای تشخیص روده بزرگ از ایلئوم (قسمتی ازروده کوچک است که به روده بزرگ متصل می شود و معمولا اولین منطقه ای است که به بیماری کرون مبتلا می گردد) شوند.الگوی بیان ژن در یکی از زیر تیپ بیماری شبیه بافت کولون سالم است اما بیان ژن در زیر تیپ دیگر الگو مشابه با ایلئوم دارد.
علاوه بر تجزیه و تحلیل بیان ژن در بافت های نمونه، دکتر شیخ و همکارانش شاخص اپی ژنتیک DNAبافت که می تواند موجب اجازه و یا سرکوب فعالیت ژن شود نیز بررسی های انجام داده اند. این تیم تمایز متفاوت بین دو نوع کرون را نتیجه تفاوت در بیان ژن ناشی از وریشن هاو تغییرات در برنامه نویسی هسته سلول های بیمار می دانند.
این محققان اطمینان می دهند که در این نتایج بدست آمده از نمونه های بزرگسالان که عمل جراحی انجام داده بودند هیچگونه انحرافی ناشی از درمان و سابقه بیماری وجود ندارد. برای اثبات این ادعا داده های 201 کودک که به تازگی بیماری کرون آنها تشخیص داده شده است و هنوز مورد درمان قرار نگرفته بودند، مورد بررسی قرار دادند. نتایج کاملا مشابهی از هر دو گروه بدست آمد.
دکتر شیخ در این باره می گوید: این نتایج نشان می دهد که تفاوت زیرتایپ ها اساس مولکولی و ژنومی دارد و کاملا از سابقه و سن بیمار مستقل می باشد. این دو الگو متفاوت مولکولی موجببروز دو فرم کلینیکی متفاوت می گردد.
برای مثال، بیماران با زیرگروه روده بزرگ مانند بیشتر احتمال دارد به التهاب روده در طول کولونوسکوپی، بیماری رکتوم، و التهاب روده بزرگ شدید که نیاز به برداشتن روده بزرگ باشد مبتلا گردد.در کار آینده، دکتر شیخ و همکاران قصد دارند یک آزمون تشخیصی با استفاده از نمونه بافت یا خون گرفته شده از کولونوسکوپی معمول را ارائه دهند. با شناسایی که زیرگروه کرون بیمار ارائه دهندگان مراقبت های بهداشتی می تواند بهترین درمان برای درمان وی تعیین کنند.
Weiser, M., Simon, J.M., Kochar, B., Tovar, A., Israel, J.W., Robinson, A., Gipson, G.R., Schaner, M.S., Herfarth, H.H., Sartor, R.B., McGovern, D.P., Rahbar, R., Sadiq, T.S., Koruda, M.J., Furey, T.S., Sheikh, S.Z., 2016. Molecular classification of Crohns disease reveals two clinically relevant subtypes. Gut
[1] The journal Gut
اگر به یک وب سایت یا فروشگاه رایگان با فضای نامحدود و امکانات فراوان نیاز دارید بی درنگ دکمه زیر را کلیک نمایید.
ایجاد وب سایت یا